- Варикоцеле
- Протезирование полового члена
- Обрезание крайней плоти
- Преждевременное семяизвержение
- Болезнь Пейрони
- Искривление полового члена
- Стриктура мочеиспускательного канала
- Лечение олеогранулемы
- Эректильная дисфункция
- Аномалии полового члена
- Аномалии уретры
- Травмы полового члена
- Лечение фимоза
- Лечение парафимоза
- Короткая уздечка крайней плоти
- Оперативная андрология
- Увеличение полового члена
- Имплантация полового члена
- Пластическая андрология
- Мужское бесплодие
- Гидроцеле
- Другие заболевания
Хирургическое лечение варикоцеле у мужчин с бесплодием
Варикоцеле является одной и самой частых причин мужского бесплодия. Распространенность варикоцеле достигает 15% среди всего мужского населения, а среди бесплодных мужчин – 40% [1]. Приблизительно у 70% пациентов с вторичным бесплодием варикоцеле является главным этиологическим фактором [2]. Понимание патофизиологии, лечения и результатов лечения варикоцеле за последние десятилетия значительно возросло.
История изучения проблемы варикоцеле уходит в глубину веков. Впервые о варикоцеле упоминается в трудах Celsius в первом веке нашей эры, он описал расширение вен семенного канатика и отметил связь варикоцеле атрофией яичка [3]. Позднее, в XIII веке, Ambroise Pare (1500-1590) описал эту сосудистую аномалию как содержащую «меланхоличную кровь». В 1856 году, Curling был первым связавшим варикоцеле с мужским бесплодием и отметил снижение «секреторной силы желез» при наличии варикоцеле [4]. В двадцатом столетии многие хирурги доказали наличие взаимосвязи между «снижением выработки сперматозоидов» и варикоцеле и последующим улучшением фертильности после его коррекции. В 1955 году Tulloch первым показал результаты лечения бесплодия после оперативной коррекции варикоцеле. В настоящее время лечение варикоцеле является самым частым оперативным пособием при мужском бесплодии [5].
С патофизиологической точки зрения при варикоцеле происходят следующие изменения. В 1978 году Greenberg и соавт. [6] не только выяснили, что варикоцеле атрофия яичка связано, но и то, что эти изменения прогрессируют с годами. У бесплодных пациентов с варикоцеле выявлены снижение концентрации, подвижности сперматозоидов и аномалии морфологии. Также в работе была показана связь варикоцеле с аномальными показателями тестостерона и фолликул – стимулирующего гормона [7]. Множество теорий пытались объяснить причину нарушения сперматогенеза у бесплодных пациентов с варикоцеле. Наиболее принятой в настоящее время является теория «тепловой кастрации» - нарушение венозного оттока приводит к нарушениям теплообмена семенного канатика и местному повышению температуры в мошонке. Повышение температуры в свою очередь нарушает сперматогенез. Таким образом, одностороннее варикоцеле может оказывать влияние на теплообмен обоих яичек [8,9]. Повышенная скротальная температура вызывает снижение синтеза тестостерона клетками Лейдига, повреждению термолабильных мембран герминативных клеток, снижению биосинтеза белка, нарушению транспорта аминокислот и нарушению функции и морфологии клеток Сертоли [10-14].
Другие теории не настолько детально описывают влияние варикоцеле на сперматогенез, включая депривацию кислорода, сниженный венозный отток, приводящий к нарушению выделения гонадотропинов из ткани яичек, и снижению содержания оксидантов в сперме. Allamaneni и соавт. [15] продемонстрировали наличие связи между активными формами кислорода (АФК) эякулята и степенью варикоцеле. Авторы доказали, что повышение АФК наблюдается чаще у мужчин со 2 и 3 степенью варикоцеле чаще, чем у мужчин с 1 степенью варикоцеле. Еще одно последнее исследование выявило, что уровни оксидантов значительно выше в сперме бесплодных, чем в сперме здоровых мужчин [16]. Эта работа показала, что варикоцеле значительно увеличивает уровень оксидантов в семени бесплодных пациентов, и то, что после лечения варикоцеле уровень оксидантов снижается. На самом же деле, обычно повреждение ткани яичка вызывается не каким то одним, а множеством механизмов, что в итоге и приводит к бесплодию.
Понимание механизмов улучшения параметров эякулята и гормонов после лечения варикоцеле за последнее время значительно возросло. К примеру, стало известно, что коррекция варикоцеле улучшает не только подвижность сперматозоидов, концентрацию и морфологию, но и специфические функциональные дефекты сперматозоидов [7,17-20]. После лечения увеличивается способность сперматозоидов к пенетрации [18], снижает уровень оксидантных факторов (АФК) [19] и фрагментации ДНК [17,20]. После коррекции отмечается также улучшение уровней фолликул – стимулирующего гормона и тестостерона [7,21]. Su и соавт. [21] продемонстрировали значительное увеличение сывороточного уровня тестостерона с 319 ±12 до 409 ± 23 нг/дл после оперативного лечения при варикоцеле. Cayan и соавт. [7] также показали значительное снижение уровня фолликул – стимулирующего гормона с 15,21 мU/мл до 10,82 мU/мл после операции. В 1987 году, Kass and Belman [22], были первыми, показавшими, что после перенесенного оперативного лечения увеличивается объем яичка. В итоге, частота наступления беременности после лечения увеличивалась, несмотря на отсутствие серьезных изменений спермограммы [23]. Полагается, что улучшение функциональных факторов невозможно измерить рутинными методами, что и может объяснять такой положительный эффект.
В 1955 году Tulloch [24], был одним из первых хирургов, предложивший пациентам с азооспермией коррекцию варикоцеле Хирургическое лечение, как он доказал, приводит к восстановлению сперматогенеза и последующему увеличению частоты наступления беременностей у партнерш пациентов с азооспермией. С тех пор, множество других работ подтвердили эти результаты. Matthews и соавт. [25] показали, что у 55% мужчин с азооспермией и 69% мужчин с отсутствием подвижных сперматозиодов до лечения, после коррекции варикоцеле в эякуляте появляются подвижные формы. Kim с соавт. [26] приводят данные об улучшении показателей спермограммы у мужчин с азооспермией с гистологически подтвержденными тяжелыми формами нарушения сперматогенеза. Некоторые авторы демонстрируют лучшие результаты оперативного лечения варикоцеле в отношении фертильности, при обнаружении сперматозоидов или сперматид в дооперационной биопсии яичка [25-27]. Тем не менее, существуют работы, в которых показано редкое достижение значительного улучшения параметров эякулята у мужчин с необструктивной азооспермией после коррекции варикоцеле [28].
В настоящее время диагностика варикоцеле не представляет трудностей. Первично варикоцеле диагностируется при физикальном обследовании. Пациентов нужно осматривать в положении стоя и лежа. В ортостазе пациента нужно попросить выполнить пробу Вальсальвы для того, чтобы врач смог оценить обратный заброс крови. Помогает улучшить диагностику варикоцеле УЗИ дуплексное. С момента его внедрения в практику, использование таких методов, как венография, Допплеровская стетоскопия и радиоизотопных исследований значительно сократилось. Тем не менее, стоит отметить, что диагноз варикоцеле устанавливается при физикальном обследовании, и ультразвуковое исследование должно использоваться для дополнения и подтверждения результатов первичного осмотра. Большинство клиницистов могут согласиться с тем, что диагноз варикоцеле, установленный ультразвуковым исследованием, должен базироваться на том, что у пациента имеются расширенные до 2-3 мм вены семенного канатика и обратный венозный сброс при пробе Вальсальвы. В настоящее время отсутствуют стандарты и четкие критерии установления ультразвукового диагноза варикоцеле. Субклиническое варикоцеле, непальпируемое при физикальном обследовании, чаще выявляется рентгенологически. Большинство авторов согласны с тем, что субклиническим считается варикозное расширение вен семенного канатика менее 3 мм диаметром [29]. В отношении клинической значимости субклинического варикоцеле всегда существовало много дебатов. Исследования показали, что субклиническое варикоцеле не имеет значимого влияния на фертильность, и что хирургическая коррекция субклинического варикоцеле не оказывает значимого улучшения фертильности [30]. Тем не менее, по данным наших собственных наблюдений это далеко не всегда так. Рентгенологические методы исследования должны применяться только в спорных случаях или для диагностики рецидивного или персистирующего варикоцеле.
Несмотря на отсутствие единых подходов к определению показаний к оперативному лечению, Американская Урологическая Ассоциация рекомендует выполнение операции при варикоцеле у мужчин в случае наличия следующих четырех условий [31]:
1. Нормальная фертильность партнерши или потенциально излечимые факторы нарушения ее фертильности;
2. Подтвержденное бесплодие пары
3. Пальпируемое варикоцеле, или, в случае подозрения, выявленное по данным ультразвукового исследования.
4. У партнера имеется один или более нарушенный показатель спермограммы.
Мужчинам, имеющим варикоцеле и измененные показатели эякулята, планирующим зачатие ребенка в будущем, должна быть предложена коррекция варикоцеле. Подросткам оперативное лечение проводится в случае наличия болей в яичке или уменьшения объема яичка. Если у таких пациентов нет гипотрофии яичка, то нужно проводить ежегодное физикальное обследование и анализ эякулята. Эти пациенты и их семьи должны быть информированы о проблемах и противоречиях в в определении показаний к оперативному лечению варикоцеле у подростков.
В настоящее время существует несколько общепринятых хирургических доступа при выполнении варикоцелэктомии. Скротальный доступ первым был предложен в хирургическом лечении. В 1904 году, Hartman первым описал радиальную резекцию мошонки и наружную перевязку варикозно расширенных вен [32]. В настоящее время скротальный доступ не применяется ввиду высокого риска повреждения тестикулярной артерии и высокой частоты рецидивов. Применяется три основных хирургических доступа: паховый, подпаховый и ретроперитонеальный (схема 1.) Ретроперитонеальный доступ можно использовать открыто или лапароскопически. Каждый из этих доступов имеет свои достоинства и недостатки.
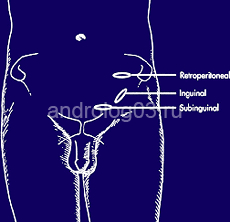
Открытый ретроперитонеальный доступ (Palomo) подразумевает межмышечный доступ. Брюшина сдвигается медиально и семенные сосуды лигируются латеральнее мочеточника. Лапароскопический ретроперитонеальный доступ также описан с методикой сохранения или резекции артерии. По данным крупных исследований эффективность лапароскопического оперативного вмешательства не выше открытого, вследствие чего лапароскопия применяется редко [33].
Паховый доступ (Ivanissevich) подразумевает произведение разреза выше наружного пахового кольца и рассечение наружной косой фасции. Можно выполнить 3-4 сантиметровый «мини» паховый разрез. Варикоцеле в этой области в основном представлено типичным сосудистым пучком, в котором артерия следует позади или прилегает к венам. Часто рядом присутствуют изолированные вены. Яичковая артерия прилегает к расположенной поверхностно крупной вене приблизительно в 50% случаев [34].
Подпаховый доступ не требует рассечения фасции и теоретически снижает болезненность и ускоряет заживление раны в послеоперационном периоде. В этой области вены имеют рассыпной тип строения, и требуется перевязка большого количества вен малого калибра. Hopps и соавт. [35] в своей работе продемонстрировали, что внутренние сперматические артерии были окружены сопутствующими венами на подпаховом уровне в три раза чаще, чем при паховом доступе. Артерии на этом уровне оканчиваются, и их случайное повреждение вызывает высокий риск развития атрофии яичка. Chan и соавт. [36] отметили 19 случаев повреждения тестикулярной артерии из 2102 выполненных ими микрохирургических варикоцелэктомий паховым доступом. Последующая атрофия яичек была отмечена лишь у одного пациента. Тем не менее, общий риск развития атрофии яичек был менее 1%.
Впервые о чрескожной эмболизации варикозно расширенных вен было сообщено в 1978 году [37]. С тех пор эта методика претерпела множество модификаций. Чрескожная эмболизация варикозно расширенных вен семенного канатика в основном не является первичным методом лечения по причине высокой частоты рецидивов. Pryor and Howards [38] показали, что успех операции достигается в 68%, принимая в расчет неудачные попытки первичного лечения и частоту рецидивов. Использование данной методики оперативного лечения оправдано в случаях рецидива варикоцеле, когда требуется проведение рентгенологического исследования.
С широким внедрением новых технологий в хирургическую практику оперативное пособие при варикоцеле также дополнилось некоторыми нововведениями. Хирургический микроскоп и интраоперационное использование Допплеровского ультразвукового исследования значительно усовершенствовали хирургические методы лечения варикоцеле и как следствие результаты лечения. Главное преимущество микрохирургического метода перед простой хирургической техникой выполнения варикоцелэктомии заключается в значительном сокращении послеоперационных осложнений, таких как повреждение тестикулярной артерии, развитие гидроцеле, и рецидив варикоцеле. Частота развития гидроцеле после немикрохирургической операции варьирует от 3 до 39% [39,40], в то время как при использовании хирургического микроскопа такие осложнения редки [41]. Эти результаты обусловлены возможностью более тщательного выделения и сохранения лимфатических сосудов. Частота рецидивов при использовании микрохирургической методики паховым доступом составляет 1 и 2% в сравнении с 9 и 16% при простой варикоцелэктомии паховым доступом [41-43]. При выполнении стандартной варикоцелэктомии подпаховым доступом рецидив возникает в 5-20% [40,44].
Самыми частыми осложнениями после варикоцелэктомии являются развитие гидроцеле, рецидив варикоцеле и повреждение яичковой артерии. Частота развития этих осложнений напрямую зависит от выбора доступа и опыта хирурга. С внедрением микроскопа и интраоперационного Допплеровского исследования частота развития осложнений значительно снизилась.
Большинство исследований демонстрируют улучшение параметров эякулята после варикоцелэктомии [5]. Однако в отношении частоты наступления беременности и фертильности данные противоречивы [45-47]. Мета-анализ 22 исследований, включавших 2989 пациентов, перенесших варикоцелэктомию, показал следующие результаты. У 71 % пациентов отмечено улучшение показателей спермограммы после операции, а в 37% отмечено наступление беременности [48]. Последний Кохрановский обзор оценивал все рандоминизированные контролируемые работы, посвященные оперативному лечению варикоцеле [49]. Только три из восьми рандоминизированных контролируемых исследований включали пациентов с изменениями в спермограмме и пальпируемым варикоцеле. В этих работах оценивались результаты лечения 120 пациентов с варикоцеле, и 117 пациентов группы контроля. Анализ показал значительное увеличение частоты наступления беременности у партнерш пациентов после перенесенной варикоцелэктомии (36,4%) в сравнении с группой контроля (20%). Тем не менее, методологическое качество и статистическая сила данных работ были весьма слабыми.
Факторы, предсказывающие эффективность оперативного лечения всегда вызывали интерес у исследователей, поскольку могли определить группу пациентов с наиболее благоприятными результатами лечения. Marks и соавт. [50] отметили четыре предоперационных фактора, связанных с повышенной частотой наступления беременности в послеоперационном периоде у партнерш: 1) малая степень атрофии яичка; 2) концентрация сперматозиодов более 50 млн; 3) подвижность сперматозиодов более 60%; 4) уровень сывороточного фолликул-стимулирующего гормоа менее 300 нг/мл. Kamal и соавт. [51] показали, что в группе пациентов с количеством сперматозиодов более 5 млн/мл частота наступления беременности партнерши после коррекции варикоцеле составила 61 % в сравнении 8% в группе мужчин, у которых количество спермотозоидов было менее 5 млн/мл. Хотя ранние работы отмечали необходимость проведения преоперациооного стимулирующего теста с гонадотропин-релизинг гормоном для определения результатов микрохирургической варикоцелэктомии, в настоящее время исследователи доказали отсутствие необходимости этой методики [52].
Наша клиника в течение длительного времени занимается проблемами диагностики и лечения варикоцеле у мужчин с бесплодием. В данном разделе мы хотели привести собственный опыт по микрохирургичесой коррекции варикоцеле у мужчин с бесплодием. В нашей клинике 355 больным с патозооспермией и варикоцеле (средний возраст 34,5±8,3 года), из которых 204 – с левосторонним варикоцеле и 151 – с двухсторонним варикоцеле, после проведения ультразвуковой допплерографии сосудов мошонки, оценки гормонального статуса и анализа спермограммы была выполнена подпаховая микрохирургическая варикоцелэктомия слева под эпидуральной анестезией с последующим контрольным обследованием. У всех больных выявлена астенозооспермия, в 87% случаев сочетающаяся с тератозооспермией, а в 45% случаев – с олигозооспермией. Средняя разница в объеме между левым и правым яичком составила 12,3±3,8%. Средняя длительность операции составила 49±10,3 мин. В послеоперационном периоде увеличение количества активно-подвижных сперматозоидов отмечалось у 63,9% больных, улучшить морфологию сперматозоидов получилось у 54,7%, наступление беременности – у 47,9%. Частота наступления беременности партнерш после микрохирургической варикоцелэктомии слева у больных с двухстороннем варикоцеле была почти 2 раза меньше, чем при одностороннем. Ближайшие и отдаленные послеоперационные осложнения отсутствовали. Наш опыт показывает необходимость выполнения двухсторонней операции у больных с двухсторонним варикоцеле. При контрольной допплерографии через 12 мес. послеоперационный рецидив выявлен у 2 (0,6%) больных.
Подводя итоги, следует сказать, что со времени первого упоминания о варикоцеле в первом веке, наше понимание патофизиологии, методов и результатов лечения значительно возросло. Доказанным считается отрицательное влияние варикоцеле на мужское бесплодие посредством множества механизмов, таких как подвижность сперматозоидов, морфологии и количества и повышения уровней АФК и частоты фрагментаций ДНК. Коррекция варикоцеле, как было показано, улучшает качество эякулята и частоту наступления беременности у партнерш. Методы лечения эволюционировали от скротальных методик до паховых и подпаховых методов с применением микроскопов и Допплеровского ультразвукового исследования. Применение этих усовершенствований значительно снизили частоту развития интраоперационных осложнений и рецидива варикоцеле. Нам известны положительные результаты лечения у пациентов с азооспермией. По причине того, что варикоцеле является главной причиной мужского бесплодия в мире, неудивительно, что исследователи продолжают искать лучшие пути диагностики и лечения этой сосудистой аномалии.
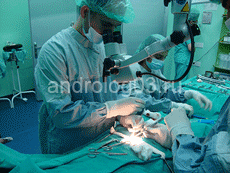
Рисунок 1. Микрохирургическая варикоцелэктомия.
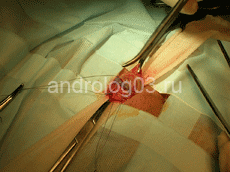
Рисунок 2. Выделенный семенной канатик. Визуализируется варикозно-расширенная вена.
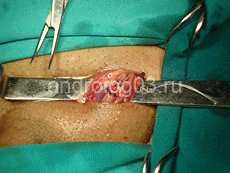
Рисунок 3. Перевязанные варикозно-расширенные вены семенного канатика.

Рисунок 4. Внешний вид после операции.
Список литературы:
1. Nagler HM, Martinis FG. Varicocele. In: Lipshultz LI, Howards S, editors. Infertility in the male. St. Louis (MO): Mosby Year Book; 1997. p. 336–59.
2. Witt MA, Lipshultz LI. Varicocele: a progressive or static lesion? Urology 1993;42(5):541–3.
3. Kaufman DG, Nagler HM. Specific nonsurgical therapy in male infertility. Urol Clin North Am 1987;14(3):489–98.
4. Curling TB. A practical treatise on the disease of the testis and of the spermatic cord and scrotum. Philadelphia: Blanchard and Lea; 1856.
5. Schlesinger MH, Wilets IF, Nagler HM. Treatment outcome after varicocelectomy: a critical analysis. Urol Clin North Am 1994;21(3):517–29.
6. Greenberg SH, Lipshultz LI, Wein AJ. Experience with 425 subfertile male patients. J Urol 1978; 119(4):507–10.
7. Cayan S, Kadioglu A, Orhan I, et al. The effect of microsurgical varicocelectomy on serum follicle stimulating hormone, testosterone and free testosterone levels in infertile men with varicocele. BJU Int 1999;84(9):1046–9.
8. Amelar RD, Dubin L. Therapeutic implications of left, right, and bilateral varicocelectomy. Urology 1987;30(1):53–9.
9. Goldstein M, Eid JF. Elevation of intratesticular and scrotal skin surface temperature in men with varicocele. J Urol 1989;142(3):743–5.
10. Fujisawa M, Yoshida S, Matsumoto O, et al. Deoxyribonucleic acid polymerase activity in the testes of infertile men with varicocele. Fertil Steril 1988;50(5):795–800.
11. Fujisawa M, Yoshida S, Kojima K, et al. Biochemical changes in testicular varicocele. Arch Androl 1989;22(2):149–59.
12. Gorelick JI, Goldstein M. Loss of fertility in men with varicocele. Fertil Steril 1993;59(3):613–6.
13. Mieusset R, Bujan L. Testicular heating and its possible contributions to male infertility: a review. Int J Androl 1995;18(4):169–84.
14. Simsek F, Turkeri L, Cevik I, et al. Role of apoptosis in testicular tissue damage caused by varicocele. Arch Esp Urol 1998;51(9):947–50.
15. Allamaneni SS, Naughton CK, Sharma RK, et al. Increased seminal reactive oxygen species levels in patients with varicoceles correlate with varicocele grade but not with testis size. Fertil Steril 2004; 82(6):1684–6.
16. Khera M, Najari B, Alukal J, et al. The effect of varicocele repair on semen reactive oxygen species activity in infertile men [abstract]. Fertil Steril 2007;88(Suppl 1):S387–8.
17. Mostafa T, Anis TH, El-Nashar A, et al. Varicocelectomy reduces reactive oxygen species levels and increases antioxidant activity of seminal plasma from infertile men with varicocele. Int J Androl 2001;24(5):261–5.
18. Ohl D, McCarthy JD, Schuster TG. The effect of varicocele on optimized sperm penetration assay [abstract]. Fertil Steril 2007;76:S48.
19. Schatte EC, Hirshberg SJ, Fallick ML, et al. Varicocelectomy improves sperm strict morphology and motility. J Urol 1998;160(4):1338–40.
20. Zini A, Blumenfeld A, Libman J, et al. Beneficial effect of microsurgical varicocelectomy on human sperm DNA integrity. Hum Reprod 2005;20(4): 1018–21.
21. Su LM, Goldstein M, Schlegel PN. The effect of varicocelectomy on serum testosterone levels in infertile men with varicoceles. J Urol 1995;154(5): 1752–5.
22. Kass EJ, Belman AB. Reversal of testicular growth failure by varicocele ligation. J Urol 1987;137(3): 475–6.
23. Daitch JA, Bedaiwy MA, Pasqualotto EB, et al. Varicocelectomy improves intrauterine insemination success rates in men with varicocele. J Urol 2001;165(5):1510–3.
24. Tulloch WS. Varicocele in subfertility: results of treatment, 1955. J Urol 2001;166(6):2032–3.
25. Matthews GJ, Matthews ED, Goldstein M. Induction of spermatogenesis and achievement of pregnancy after microsurgical varicocelectomy in men with azoospermia and severe oligoasthenospermia. Fertil Steril 1998;70(1):71–5.
26. Kim ED, Leibman BB, Grinblat DM, et al. Varicocele repair improves semen parameters in azoospermic men with spermatogenic failure. J Urol 1999; 162(3 Pt 1):737–40.
27. Kadioglu A, Tefekli A, Cayan S, et al. Microsurgical inguinal varicocele repair in azoospermic men. Urology 2001;57(2):328–33.
28. Schlegel PN, Kaufmann J. Role of varicocelectomy in men with nonobstructive azoospermia. Fertil Steril 2004;81(6):1585–8.
29. Hoekstra T, Witt MA. The correlation of internal spermatic vein palpability with ultrasonographic diameter and reversal of venous flow. J Urol 1995; 153(1):82–4.
30. Jarow JP, Ogle SR, Eskew LA. Seminal improvement following repair of ultrasound detected subclinical varicoceles. J Urol 1996;155(4):1287–90.
31. Male Infertility Best Practice Policy Committee of the American Urological Association; Practice Committee of the American Society for Reproductive Medicine. Report on varicocele and infertility [abstract]. Fertil Steril 2004;82(Suppl 1):S142–5.
32. Noske HD, Weidner W. Varicocele: a historical perspective. World J Urol 1999;17(3):151–7.
33. Jarow JP, Assimos DG, Pittaway DE. Effectiveness of laparoscopic varicocelectomy. Urology 1993; 42(5):544–7.
34. Beck EM, Schlegel PN, Goldstein M. Intraoperative varicocele anatomy: a macroscopic and microscopic study. J Urol 1992;148(4):1190–4.
35. Hopps CV, Lemer ML, Schlegel PN, et al. Intraoperative varicocele anatomy: a microscopic study of the inguinal versus subinguinal approach. J Urol 2003;170(6 Pt 1):2366–70.
36. Chan PT, Wright EJ, Goldstein M. Incidence and postoperative outcomes of accidental ligation of the testicular artery during microsurgical varicocelectomy. J Urol 2005;173(2):482–4.
37. Lima SS, Castro MP, Costa OF. A new method for the treatment of varicocele. Andrologia 1978;10(2): 103–6.
38. Pryor JL, Howards SS. Varicocele. Urol Clin North Am 1987;14(3):499–513.
39. Amelar RD. Early and late complications of inguinal varicocelectomy. J Urol 2003;170(2 Pt 1): 366–9.
40. Szabo R, Kessler R. Hydrocele following internal spermatic vein ligation: a retrospective study and review of the literature. J Urol 1984;132(5):924–5.
41. Goldstein M, Gilbert BR, Dicker AP, et al. Microsurgical inguinal varicocelectomy with delivery of the testis: an artery and lymphatic sparing technique. J Urol 1992;148(6):1808–11.
42. Cayan S, Kadioglu TC, Tefekli A, et al. Comparison of results and complications of high ligation surgery and microsurgical high inguinal varicocelectomy in the treatment of varicocele. Urology 2000;55(5): 750–4.
43. Marmar JL, Kim Y. Subinguinal microsurgical varicocelectomy: a technical critique and statistical analysis of semen and pregnancy data. J Urol 1994;152(4):1127–32.
44. Marmar JL, DeBenedictis TJ, Praiss D. The management of varicoceles by microdissection of the spermatic cord at the external inguinal ring. Fertil Steril 1985;43(4):583–8.
45. Evers JL, Collins JA, Vandekerckhove P. Surgery or embolisation for varicocele in subfertile men. Cochrane Database Syst Rev 2001;(1):CD000479.
46. Madgar I, Weissenberg R, Lunenfeld B, et al. Controlled trial of high spermatic vein ligation for varicocele in infertile men. Fertil Steril 1995;63(1): 120–4.
47. Nieschlag E, Hertle L, Fischedick A, et al. Update on treatment of varicocele: counselling as effective as occlusion of the vena spermatica. Hum Reprod 1998;13(8):2147–50.
48. Lipshultz LI, Jarow JP. Varicocele and male subfertility. In: Speroff SJ, editor. Gynecology and obstetrics. Philadelphia: J.B. Lippincott; 1989. p. 1–12.
49. Ficarra V, Cerruto MA, Liguori G, et al. Treatment of varicocele in subfertile men: the Cochrane review, a contrary opinion. Eur Urol 2006;49(2):258–63.
50. Marks JL, McMahon R, Lipshultz LI. Predictive parameters of successful varicocele repair. J Urol 1986;136(3):609–12.
51. Kamal KM, Jarvi K, Zini A. Microsurgical varicocelectomy in the era of assisted reproductive technology: influence of initial semen quality on pregnancy rates. Fertil Steril 2001;75(5):1013–6.
52. O’Brien J, Bowles B, Kamal KM, et al. Does the gonadotropin-releasing hormone stimulation test predict clinical outcomes after microsurgical varicocelectomy? Urology 2004;63(6):1143–7.
Д.м.н., проф. Гамидов Сафаил Исраил оглы, ГОУ ВПО «Российский государственный медицинский университет Росздрава», кафедра урологии, профессор; ФГУ «Научный центр акушерства, гинекологии и перинатологии» Минздравсоцразвития России (директор – акад. РАМН, проф. Сухих Г.Т.), г. Москва; т. 777-3028, e-mail: docand@rambler.ru
Павловичев Алексей Александрович, ГОУ ВПО «Российский государственный медицинский университет Росздрава», кафедра урологии, аспирант, т. 8-926-424-8292, e-mail: alexxei4@rambler.ru
Андранович Станислав Валерьевич, ГКБ № 1 им.Н.И.Пирогова, врач-уролог, врач-УЗ-диагностики т. 8-903-726-43-52, e-mail: an.stanislav@rambler.ru
Тажетдинов Олег Халитович, ГОУ ВПО «Российский государственный медицинский университет Росздрава», кафедра урологии, аспирант, т. 8-926-698-1982, e-mail: gelotazh2007@rambler.ru


